光合作用将无机物转化为有机物并释放出氧气,为生命提供物质基础,是地球上最重要的生化反应。植物可以通过光系统吸收光能进行光合作用,但是过量的光又会对植物造成损伤,降低光合作用效率,影响植物生长发育。为了应对光损伤,植物进化出了自身的光保护基因及光保护机制。其中,光保护基因的有效表达是植物有效避免光损伤的关键,但相关的调控机制并不清楚。
2022年12月2日,广州中医药大学药用植物生理生态研究所王宏斌/靳红磊团队在Nature Communications在线发表了题为 “N6-Methyladenosine RNA Modification Regulates Photosynthesis during Photodamage in Plants”的研究论文,发现了植物光保护转录后调控的分子开关,揭示了RNA的m6A修饰介导的转录后调控在植物光损伤条件下光合作用效率维持中的作用机制。

王宏斌/靳红磊团队前期发现了HHL1、HPE1、LPE1等一系列植物强光适应的重要调控因子(Plant Cell, 2014; Plant Physiol, 2016; PNAS; 2018);近期重点揭示了强光适应过程中重要因子的精细表达调控机制,特别是转录及翻译后调控机制(Cell Reports, 2020; Plant Physiol, 2020; JIPB, 2020; JIPB, 2022),但光保护的转录后调控机制并不清楚。值得注意的是,RNA的m6A修饰是真核生物最普遍的转录后修饰,广泛调控RNA代谢,包括mRNA的剪接、核孔输出、稳定性、翻译等过程。m6A修饰参与众多重要生物学过程,然而其在光合作用及光适应中的功能及其作用机制尚不清楚。
研究人员首先通过Dot blot以及LC-MS/MS分析了模式植物拟南芥在强光胁迫下整体m6A修饰水平的改变,发现强光诱导植物整体m6A修饰水平升高。进一步通过m6A-seq检测到大量光合作用相关转录本的m6A修饰水平发生改变,并且m6A调节子也受强光诱导表达升高,提示m6A修饰可以对强光胁迫作出动态响应。
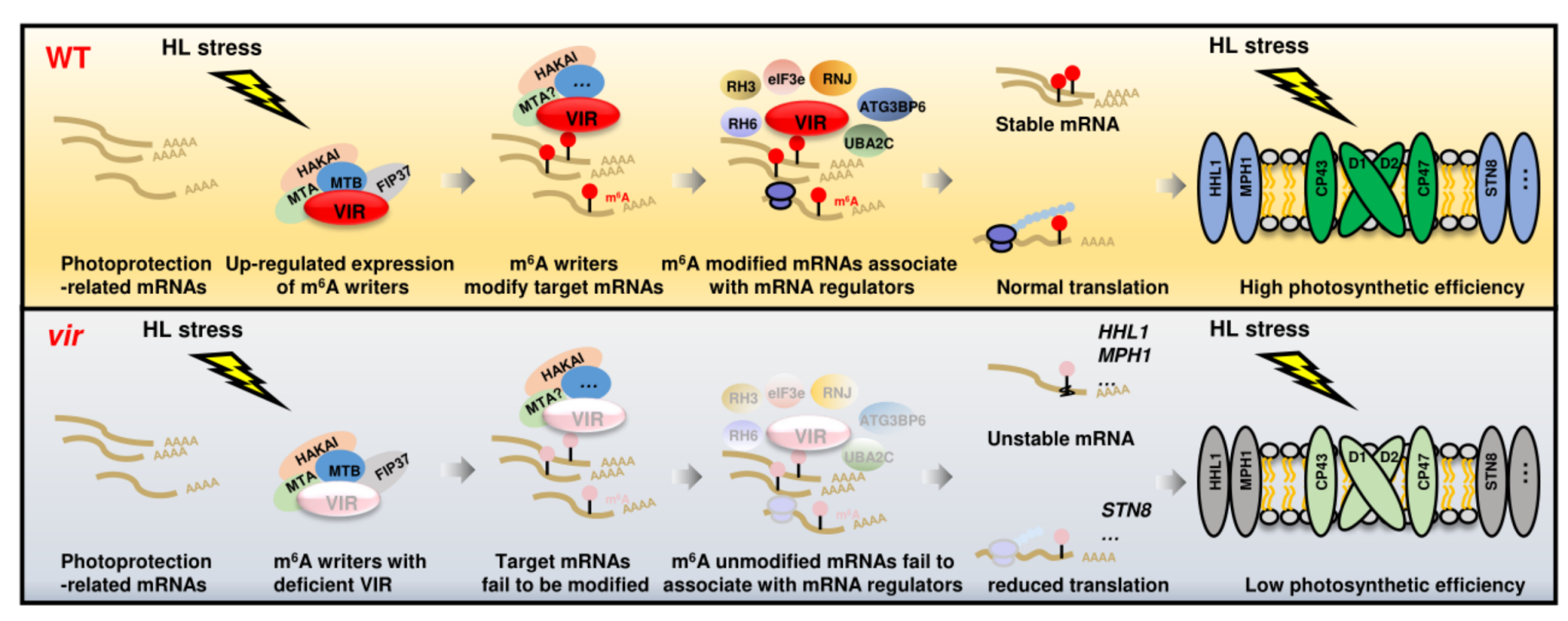
进一步,研究人员通过叶绿素荧光成像系统对拟南芥m6A调节子的突变体进行了系统筛选,发现m6A 写入器(writer) VIR功能缺陷突变体(vir-1)呈现强光超敏感表型。VIR功能缺陷导致植株在强光下的光合作用活性和光系统蛋白丰度显著降低。免疫印迹分析显示vir-1突变体中HHL1、MPH1、STN8等蛋白丰度显著降低,提示VIR是植物光保护蛋白累积所必需的。研究人员对高光处理前后的Col-0和vir-1进行了m6A-seq分析。结果发现vir-1的m6A甲基化组的拓扑结构发生显著改变,VIR依赖的m6A位点在核糖体和叶绿体相关功能方面大量富集。大量光保护相关转录本,如HHL1、MPH1、STN8等转录本的m6A修饰水平在vir-1突变体中显著降低。RNA-IP分析结果显示,VIR与HHL1、MPH1、STN8等mRNA直接结合。
转录组和翻译组分析发现,在强光下vir-1中的差异转录基因和差异翻译基因在胁迫响应和强光响应相关通路大量富集。有趣的是,VIR同时调控光保护基因的mRNA丰度及翻译效率。在mRNA丰度调控方面,VIR主要通过控制靶标基因(如HHL1、MPH1等)mRNA的切割效率来调节mRNA丰度。研究表明,VIR功能缺陷降低了HHL1和MPH1的mRNA的甲基化水平,加速了核酸酶切割及mRNA断裂,进而降低了VIR介导的m6A修饰参与光保护相关基因mRNA的稳定性。在翻译效率调控方面,靶标基因(如STN8等)在vir-1中的翻译效率降低,但是mRNA丰度没有明显改变。这提示,VIR可以调节光保护基因的mRNA稳定性、翻译效率等多个重要过程,是光保护基因转录后调控的重要分子开关。
更有趣的是,VIR及其靶标mRNA与大量核糖体蛋白以及RNA稳定、加工、翻译相关功能调控因子(如eIF3e、RNJ 、RH3、 RH6等)结合,提示VIR及其甲基化修饰的mRNA可以招募RNA功能调控因子,进而调节光保护基因的RNA稳定性、翻译等转录后重要环节。这项研究发现了光保护转录后调控的重要分子开关VIR,揭示了RNA的m6A修饰介导的表观遗传调控在植物强光适应中的作用机制,对于理解植物逆境条件下光合作用效率维持机理具有重要的理论价值。
广州中医药大学药用植物生理生态研究所靳红磊教授和王宏斌教授为本论文的共同通讯作者,张曼博士(现任职于广东省农科院果树所)为第一作者,中山大学任间教授、骆观正教授和刘兵副教授,广州中医药大学第三附属医院赵可伟教授,以及捷克农科院Kamil Růžička教授也参与了本项研究,相关工作得到了国家自然科学基金和广东省特支计划等项目的资助。
文章网址链接:https://www.nature.com/articles/s41467-022-35146-z
参考文献:
1. HYPERSENSITIVE TO HIGH LIGHT1 Interacts with LOW QUANTUM YIELD OF PHOTOSYSTEM II1 and Functions in Protection of Photosystem II from Photodamage in Arabidopsis. Honglei Jin, Bing Liu, Lujun Luo, Dongru Feng, Peng Wang, Jun Liu, Qingen Da, Yanming He, Kangbiao Qi, Jinfa Wang, and Hong-Bin Wang*. Plant Cell,2014, 26 (3):1213-1229.
2. Optimization of Light Harvesting Pigment Improves Photosynthetic Efficiency in Arabidopsis. Honglei Jin, Mengshu Li, Sujuan Duan, Mei Fu, Xiaoxiao Dong, Bing Liu, Dongru Feng, Jinfa Wang* &Hong-Bin Wang*. Plant Physiology,2016,172 (3):1720–1731.
3. LOW PHOTOSYNTHETIC EFFICIENCY 1 is required for light-regulated photosystem II biogenesis in Arabidopsis. Honglei Jin#, Mei Fu#, Zhikun Duan#, Sujuan Duan, Mengshu Li, Xiaoxiao Dong, Bing Liu, Dongru Feng, Jinfa Wang, Lianwei Peng and Hong-Bin Wang,*. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115 (26): E6075-E6084.
4. Signaling from Plastid Genome Stability Modulates Endoreplication and Cell Cycle during Plant Development. Sujuan Duan, Lili Hu, Beibei Dong, Hong-Lei Jin*, and Hong-Bin Wang*. Cell Reports, 2020, 32 (6): 108019
5. Light Signaling-Dependent Regulation of Photosystem II Biogenesis and Functional Maintenance. Xue Li, Hong-Bin Wang, and Hong-Lei Jin*. Plant Physiology, 2020, 183 (4):1855-1868.
6. Plastid ribosomal protein LPE2 is involved in photosynthesis and the response to C/N balance in Arabidopsis thaliana. Xiaoxiao Dong#, Sujuan Duan#, Hong-Bin Wang, Hong-Lei Jin*. Journal of Integrative Plant Biology, 2020, 62(9): 1418–1432.
7. Quantitative proteomics reveals redox-based functional regulation of photosynthesis under fluctuating light in plants. Qi Chen, Yixian Xiao, Yu Ming, Rong Peng, Jiliang Hu, Hong-Bin Wang, Hong-Lei Jin*. Journal of Integrative Plant Biology, 2022, 64 (11): 2168-2186.

